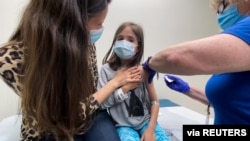
La Agencia de Medicamentos y Alimentos de Estados Unidos (FDA, por sus siglas en inglés) autorizó el lunes la administración de la vacuna Pfizer/BioNTech COVID-19 en adolescentes de entre 12 y 15 años de edad.
Con esta autorización queda enmendada una orientación anterior del 11 de diciembre de 2020 que solo la autorizaba para adolescentes desde los 16 años.
Tras una sesión informativa, la FDA anunció que esta extensión en los grupos de edades “es un paso significativo en la lucha contra la pandemia de COVID-19", según declaraciones de la comisionada interina de la FDA, Janet Woodcock.
El presidente Joe Biden tomó la erradicación del nuevo coronavirus como uno de los pilares de su campaña electoral. Al llegar a la Casa Blanca anunció su propósito de vacunar a cien millones de personas en EE. UU. en los primeros cien días de su gobierno -una meta superada antes de tiempo- y ha anunciado que espera que el 70% de los adultos se haya vacunado para el 4 de julio de 2021.
Citando informes de los Centros para el Control y la Prevención de Enfermedades (CDC), la entidad indica que han sido detectados aproximadamente 1,5 millones de casos de COVID-19 en personas de 11 a 17 años.
La decisión de extender la aplicación de las vacunas a grupos de menor edad tiene como antecedente un ensayo médico con 2260 participantes de 12 a 15 años “controlado con placebo, en curso en Estados Unidos”.
La FDA indicó que del total de participantes, 1.131 de ellos recibieron la vacuna y 1.129 recibieron un placebo de solución salina. A más de la mitad se les dio seguimiento “durante al menos dos meses después de la segunda dosis”, indica la declaración.
Los efectos secundarios de los que se dio cuenta, en una mayoría, fueron dolor en el área de la inyección, cansancio, dolor de cabeza, escalofríos, dolor muscular, fiebre y dolor en las articulaciones, asegura el reporte.
La agencia alerta que nadie con antecedentes de una reacción alérgica grave debe recibir la vacuna.
Aun con las precisiones por el resultado de los estudios, la FDA ha especificado que en la actualidad los datos para determinar si la vacuna puede prevenir la transmisión del virus de persona a persona son “limitados”. En ese sentido, también advierte que “no hay datos disponibles para determinar durante cuánto tiempo brindará protección la vacuna”.
Al día de hoy Estados Unidos acumula 32.736.396 casos de COVID-19 y 582.081 muertes por la infección del virus. El mundo está punto de alcanzar la cifra de los 160 millones de casos y ha sobrepasado los 3 millones de decesos, según datos de la universidad Johns Hopkins.
¡Conéctate con la Voz de América! Suscríbete a nuestro canal de YouTube y activa las notificaciones; o bien, síguenos en redes sociales: Facebook, Twitter e Instagram.